"О кальциевом гомеостазе"
Как известно, ионизированный кальций играет важную роль в жизнедеятельности организма. Помимо формирования костной ткани и участия в свертывающей системе крови, кальций посредством кальцийзависимого белка кальмодулина участвует в регуляции разнообразных биологических процессов: секреции инсулина, тиреоидных гормонов, гормонов надпочечников, высвобождении нейромедиаторов, кишечной секреции, клеточной пролиферации, высвобождении лизосомных ферментов, синтезе простагландинов, распаде микротрубочек, лейкоцитарном фагоцитозе и так далее. Кальций занимает важнейшее место в функционировании центральных и периферических нейронов [14]. Ионы кальция необходимы для мышечного сокращения и служат важнейшими посредниками во внутриклеточной передаче сигнала от рецепторов гормонов и факторов роста [7]. Именно значимость для функционирования организма является причиной строгого поддержания постоянной концентрации ионов кальция в сыворотке крови: изменение ее лишь на 1% приводит в действие механизм, восстанавливающий необходимую концентрацию [14].
Постоянство концентрации ионов кальция в сыворотке крови поддерживается функциональной системой, которую можно назвать кальциевым гомеостатом. В этой системе можно выделить центральную, сенсорно-регуляторную и эффекторную части. К эффекторной части можно отнести почки, желудочно-кишечный тракт и костную систему. Следствием воздействия на эти составляющие является изменение концентрации ионов кальция в сыворотке крови. Эффекторная часть в данной работе не рассматривается.
Сенсорно-регуляторный отдел кальциевого гомеостата представлен паращитовидными железами, секретирующими паратиреоидный гормон (ПТГ), и С-клетками щитовидной железы, секретирующими кальцитонин (КТ). О регуляции КТ известны следующие факты: основными стимулами секреции КТ считают повышенный уровень кальция и повышенные уровни гастрина, секретина и холецистокинина [12], катехоламины (через b-рецепторы), глюкагон [3]; при стрессе уровень КТ повышается [11]; мю-агонисты (морфин) снижают содержание КТ в щитовидной железе, а дельта-агонисты, наоборот, увеличивают количество КТ в щитовидной железе [8]; ингибирующее действие на секрецию КТ оказывают повышенные концентрации ПТГ [12]; КТ вызывает торможение секреции пролактина (ПРЛ) и АКТГ в гипофизе [10, 11]; КТ снижал у людей подъем концентрации СТГ, вызванный введением глюкозы и инсулина [11]; КТ тормозит реакцию ТТГ и ЛГ на инфузию соответствующих гипоталамических рилизинг-факторов – ТРГ и ГнРГ [11]. КТ оказывает анальгезирующее действие, которое, по-видимому, имеет центральный генез и связано с повышением уровня эндогенных опиоидов [5,12]. Известно также, что введение КТ вызывает два взаимосвязанных процесса: усиление секреции соматостатина (СС) и уменьшение секреции гастрина – кривые этих показателей выглядят как зеркальное отображение [11]. Поскольку СС снижает выделение гастрина [8], высказано предположение, что КТ ингибирует деятельность желудочных желез посредством СС, так как рецепторы КТ не обнаружены ни в желудочных железах, ни в поджелудочной железе и др. [11]. Секрецию КТ можно активизировать пероральным приемом кальция, не вызывающим видимого изменения концентрации кальция в сыворотке [12]. Очевидно, что эта активизация опосредована повышением секреции гастрина.
О регуляции ПТГ известны следующие факты: наиболее физиологически значимым стимулом секреции ПТГ считают гипокальциемию; холинергические агонисты угнетают секрецию ПТГ; катехоламины через b-рецепторы стимулируют секрецию ПТГ; тиреоидные гормоны снижают продукцию ПТГ [12].
Известно также, что СТГ, инсулин и глюкокортикоиды увеличивают содержание кальция в сыворотке крови [12]. Вышеперечисленные факты позволяют представить сенсорно-регуляторный отдел кальциевого гомеостата в виде следующей схемы:
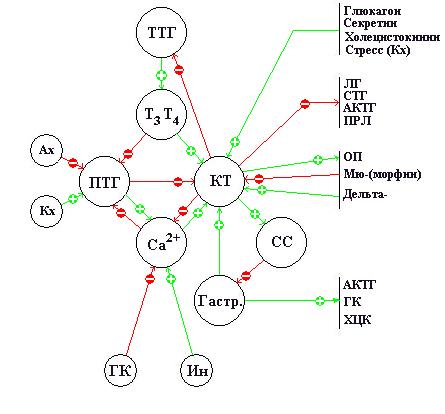
Локализация паращитовидных желез и С-клеток предполагает также и функциональную тесную взаимосвязь кальциевого гомеостата с продукцией тиреоидных гормонов. Эта связь демонстрируется изменениями концентрации гормонов в крови в раннем неонатальном периоде. Известно, что сразу же после рождения концентрация ТТГ после контакта с внешней средой достигает максимума через 30 минут с последующим падением в течение первого дня. Уровень Т4 достигает пика к концу первых суток и затем медленно снижается в течение первой недели. После рождения в течение первых 4-6 часов уровень циркулирующего Т3 увеличивается, в 3-6 раз превышая внутриутробный [9]. Высказано предположение о том, что такое повышение уровня тиреоидных гормонов в раннем неонатальном периоде возникает в результате увеличения концентрации растворенного кислорода в плазме крови новорожденного после контакта с внешней средой (см. «Об аутоиммунных заболеваниях щитовидной железы»). Известно также, что уровень КТ после первых 1-2 часов жизни также начинает расти и достигает максимума к 12 часам, после чего резко падает. Причиной подъема не является гиперкальциемия. Нет корреляции между изменениями уровня КТ и концентрациями катехоламинов, глюкагона или гастрина [16]. Результатом подъема КТ является ускоренное падение концентрации кальция, что стимулирует продукцию ПТГ, повышение концентрации которого и регистрируется после рождения одновременно со снижением кальция; через 2-3 дня уровень ПТГ достигает нормы или даже повышен (у плода уровень ПТГ низок) [16]. Очевидно, что повышение уровня КТ тесно связано с повышением уровней тиреоидных гормонов в раннем неонатальном периоде. Повышение уровня КТ в начальной стадии гипертиреоза [11] также подтверждает тесную взаимосвязь секреции КТ с секрецией тиреоидных гормонов.
К центральному отделу кальциевого гомеостата можно традиционно отнести нервную ткань, а точнее – ЦНС. С-клетки щитовидной железы происходят из нервного гребня [14]. Выделяющиеся в процессе эмбриогенеза из нервного гребня КТ-продуцирующие клетки широко распространены в организме. КТ продуцируется также в гипофизе, ЦНС – клетками, родственными С-клеткам. Однако этот КТ не поступает в общую циркуляцию [11]. Гастрин обнаружен в коре, гипоталамусе и спинномозговой жидкости [18].
Показано снижение уровня кальция в крови крыс на 50%, а в ткани мозга на 20% в результате пребывания на рационе без кальция. При введении кальция уровень его в крови повышается и его содержание в тканях мозга полностью восстанавливается. Тиропаратиреоэктомия подавляла этот эффект внутривенно введенного кальция [2]. Вышеприведенные факты можно считать подтверждением существования механизма поддержания и восстановления необходимого уровня кальция в ткани мозга с помощью сенсорно-регуляторного отдела кальциевого гомеостата. Важность стабильной концентрации кальция для функционирования ЦНС подтверждается симптоматикой при отклонении от нормального содержания кальция в крови - на первый план выступают симптомы ЦНС: при гиперкальциемии – слабость, вялость, депрессия, может возбуждение, повышение артериального давления; при гипокальциемии – тетания, судороги, эпилепсия, обмороки [4].
Показано, что интенсивность митотической активности в костном мозге и тимусе пропорциональна концентрации кальция в плазме. При отсутствии кальция большое число стимулированных антигеном клеток не может вступить в фазу активного синтеза ДНК, в результате чего иммунный ответ угнетается [17]. Удаление паращитовидных желез у крыс приводит к гипоплазии костного мозга, инволюции тимуса, снижении АОК [19]. После удаления паращитовидных желез организм становится неспособен к увеличению количества АОК и повышению титров циркулирующих антител (АТ), снижается пролиферация тимических лимфобластов, что приводит к атрофии тимуса. Эффект восстанавливается введением ПТГ или кальция [17]. Повышение концентрации кальция вызывает деление и бласттрансформацию лимфоцитов [10].
Вышеизложенные факты позволяют думать о том, что для нормального функционирования лимфоидной ткани также необходима стабильная концентрация кальция в крови. Как уже выше указывалось, гипокальциемия угнетает митотическую активность лимфоидной ткани, а гиперкальциемия, наоборот, стимулирует эту митотическую активность. В норме после нескольких циклов пролиферации лимфоцитов обычно происходит их дифференцировка, которая в целом рассматривается как процесс, альтернативный пролиферации [20]. Можно предположить, что при повышенной митотической активности клетки лимфоидной ткани могут не успевать проходить процесс дифференцировки и это также может быть причиной нарушений иммунного ответа.
В организме могут возникать ситуации, когда по той или иной причине стабильность уровня концентрации кальция в крови нарушается. Одной из причин такого нарушения является развитие аутоиммунного гипопаратиреоидизма. Изолированный гипопаратиреоидизм встречается редко, чаще он является компонентом аутоиммунного полигландулярного синдрома типа 1 (АПГС-1). Первым симптомом АПГС-1 обычно бывает хронический генерализованный гранулематозный кандидоз (кандидоз кожи и слизистых), начинающийся уже в грудном возрасте, затем присоединяется гипопаратиреоидизм, много позже – хроническая первичная надпочечниковая недостаточность [1]. Гистология паращитовидных желез была доступна в сравнительно небольшом количестве случаев аутоиммунного гипопаратиреоидизма и показала различные степени жировой замены, атрофии и лимфоцитарной инфильтрации, что предполагает возможность разрушительного процесса [26]. Клетка паращитовидной железы с помощью кальций-чувствительного рецептора (Ca-SR) реагирует на снижение концентрации внеклеточного иммунизированного кальция повышением продукции ПТГ. У пациентов с аутоиммунным гипопаратиреоидизмом обнаруживаются аутоантитела, являющиеся антителами против Ca-SR. Антигенный эпитоп локализован исключительно во внеклеточной области Ca-SR[27]. Эти аутоантитела активизируют рецептор, который, в свою очередь, повышает активность фосфатазы С и МАРК и ингибирует секрецию ПТГ. Высказано предположение, что аутоиммунный гипопаратиреоидизм может возникнуть не только вследствие цитолитического действия на паращитовидные железы, но и посредством аутоантител к Ca-SR[26]. Среди пациентов с идиопатическим гипопаратиреоидизмом антитела к Ca-SR выявлены в 49% случаев [15]. Описаны случаи гипопаратиреоидизма, где пациенты имели нормальные паращитовидные железы, не поврежденные иммунными механизмами [26]. Отмечается также, что антитела к Ca-SR определяются и в контроле до 13%, то есть у практически здоровых людей [15].
Если гипотетически предположить, что лимфоидная ткань является активным участником в процессе регуляции уровня концентрации кальция в сыворотке, то воздействие на клетки паращитовидных желез аутоантителами к Ca-SR можно расценить как регуляторное влияние лимфоидной ткани, направленное в конечном итоге на снижение концентрации кальция в крови, а антитела к Ca- SR можно считать регуляторными антителами.
Известно, что гиперкальциемия встречается при хронических гранулематозных инфекциях, в том числе и при кандидозе [4]. Под действием интерферон-гамма макрофаги человека экспрессируют 1-а-гидроксилазу, которая может превращать неактивный циркулирующий 25-гидроксихолекальциферол в активный 1,25-дигидроксихолекальциферол (называемый также витамин D3 или кальцитриол). Образование кальцитриола может быть настолько значительным, что из участка активации макрофагов он проникает в кровоток, вызывая повышение содержания кальция в крови [13]. Может возникнуть вопрос, почему не развивается гипопаратиреоидизм при других хронических гранулематозах. Можно предположить, что, например, при туберкулезе или саркоидозе повышение уровня кальция в крови таково, что симптомы гипопаратиреоидизма не проявляются. Во всяком случае, при хронических гранулематозах отмечаются поражения паращитовидных желез.
Значительно позже в течение АПГС-1 может манифестировать злокачественная анемия (пернициозная анемия, В12-дефицитная анемия, анемия Аддисона-Бирмера). Пернициозная анемия возникает в результате развития аутоиммунного гастрита, сопровождающегося потерей обкладочных клеток, продуцирующих внутренний фактор. Время прогрессии от атрофического гастрита к откровенной пернициозной анемии может охватить несколько лет [25]. В половине случаев у таких больных определяются АТ к обкладочным клеткам слизистой оболочки желудка [6]. Никакие специфические модификаторы окружающей среды, свойственные началу болезни, неидентифицированы [24].
Как известно, в желудке различают три области: дно и тело, которые содержат секретирующие соляную кислоту обкладочные клетки и пепсинсекретирующие клетки, и антрум, который содержит гастринпродуцирующие клетки. При аутоиммунном гастрите поражаются дно и тело и не затрагивается антрум. Аутоиммунный гастрит связан с аутоантителами к обкладочным клеткам и внутреннему фактору, ахлоргидрией, низкой концентрацией пепсиногена в сыворотке и высокой концентрацией гастрина в сыворотке, последнее следует из-за гиперплазии гастринпродуцирующих клеток, стимулированных ахлоргидрией [31].
Гистологически при аутоиммунном гастрите определяется мононуклеарный инфильтрат в подслизистой, простирающийся в собственную пластинку между желудочными железами, который включает в себя плазматические клетки, Т-клетки и большую популяцию не-Т-клеток (вероятно, В-клетки) [31]. Распространение клеточного инфильтрата в слизистую оболочку сопровождается дегенеративными изменениями в обкладочных и пепсинсекретирующих клетках [31]. Большинство Т-клеток экспрессировало perforin-опосредованную цитотоксичность против антигенпредставляющей клетки и вызывало Fas–Fas ligand-опосредованный апоптоз в целевых клетках [23].
Н+/К+АТФаза обкладочных клеток является орган-специфическим ферментом, признанным антигеном при аутоиммунном гастрите [28]. Желудочная Н+/К+АТФаза ответственна за секрецию водородных ионов обкладочными клетками в обмен на ионы калия. Этот энзим является основным белком мембраны выстилки секреторных канальцев обкладочных клеток. Хотя аутоантитела к обкладочным клеткам могут фиксировать комплемент и лизировать обкладочные клетки in vitro , вряд ли, чтобы эти аутоантитела были патогенными in vivo , поскольку Н+/К+АТФаза не доступна (!) для циркулирующих антител. Результаты исследований, показывающие реактивность аутоантител к обкладочным клеткам с поверхностными мембранами обкладочных клеток in vitro , могут быть объяснены потерей полярности клетки после клеточной диссоциации [31]. Повреждение аутоиммунного гастрита было индуцировано CD4 Т-клетками, которые распознают субъединицу желудочной Н+/К+АТФазы. Аутоантитела и CD8 Т-клетки, по-видимому, не имеют роли в происхождении гастрита [31]. Инфильтрирующие плазматические клетки содержат аутоантитела к антигену обкладочных клеток и к внутреннему фактору [31]. Можно думать о том, что продукция аутоантител служит для формирования специфического гастритогенного клона Т-клеток, так как Т-клетки, реагирующие на желудочный антиген, были обнаружены только в лимфатических узлах в непосредственной близости желудка [30]. Более того, при активной передаче клеток гастритогенного CD4 Т-клеточного клона сингенным нагим мышам у них развивался аутоиммунный гастрит без производства (!) аутоантител к обкладочным клеткам [28].
Отмечено, что после тимэктомии у 3х-дневных BALB/c мышей развивается аутоиммунный гастрит, связанный с CD4 Т-клетками и характеризующийся инфильтрацией слизистой, аутоантителами и потерей обкладочных клеток [22]. Известно также, что гастрин содержит ряд потенциально активных центров, имеющих структуры, свойственные тимусным гормонам [18]. Можно думать о том, что тимусные гормоны, в свою очередь, имея сходные с гастрином активные центры, могут влиять на регуляцию продукции КТ. Можно предположить, что неонатальная тимэктомия у мышей лишает лимфоидную ткань возможности с помощью тимусных гормонов влиять на регуляцию уровня кальция в крови, а развитие аутоиммунного гастрита можно определить как действие лимфоидной ткани, направленное на восстановление такой возможности. Если придерживаться вышеупомянутого предположения об активном участии лимфоидной ткани в регуляции уровня концентрации кальция в крови, то складывается впечатление, что развитие аутоиммунного гастрита с продукцией аутоантител к Н+/К+АТФазе и потерей обкладочных клеток приводит к гипергастринемии и направлено, в конечном итоге, на снижение уровня кальция в крови, также, как и при аутоиммунном гипопаратиреоидизме.
Положительные титры антител к обкладочным клеткам (РСА) описаны в широком диапазоне других аутоиммунных поражений [21]. Так, аутоиммунный тиреоидит нередко сочетается с аутоиммунным поражением желудка [6]. У детей с аутоиммунным поражением щитовидной железы обнаруживали 14-21% распространения РСА, среди них дети с хроническим лимфоцитарным тиреоидитом и болезнью Грейвса в 30% случаев имели РСА. Почти у половины из них была обнаружена гипергастринемия [29]. Этому можно найти объяснение, так как гиперкальциемия выявляется у 15-20% больных тиреотоксикозом и вызвана усиленной резорбцией кости под влиянием избытка Т4 [4].
Итак, вышеизложенное позволяет думать о том, что, очевидно, лимфоидная ткань также является активным участником регуляции уровня концентрации кальция в сыворотке крови.
ЛИТЕРАТУРА:
1. Айзенбарт Д. // Эндокринология. Под ред. Н. Лавина: пер. с англ. М. 1999 г . с 946-954
2. Баблоян Р.С., Ерицян Л.Н.// Пат. физиология и эксперим. терапия._1991_№ 2_с 13-15
3. Балаболкин М.И. Эндокринология М._1998 г.
4. Брикман А.// Эндокринология. Под ред. Н. Лавина: пер. с англ. М. 1999 г . с 413-454
5. Видаль - справочник 2004 г .
6. Виноградова Ю.Е., Шинкаркина А.П., Поверенный А.М. Аутоиммунный тиреоидит при заболеваниях системы крови.
7. Гертнер Д. // Эндокринология. Под ред. Н. Лавина: пер. с англ. М. 1999 г . с 480- 516
8. Громов Л.А. Нейропептиды._Киев, 1992 г .
9. Джаффе Р.Б.// Репродуктивная эндокринология. Под ред. С.С.К.Йена и Р.Б.Джаффе: пер. с англ. М. 1998 г . Т 2 с 364-390
10. Држевецкая И.А., Држевецкий Ю.М. ВИНИТИ Сер.: Физиология человека и животных 1983 Т 27
11. Држевецкий Ю.М.// Советская медицина_1988 г._№8_с 28-32
12. Ковалев Д.И.// Проблемы эндокринологии_1991_Т 37_№6_с 61-66
13. Ройт А., Бростофф Дж., Мейл Д. Иммунология: пер. с англ. М. 2000 г .
14. Теппермен Дж., Теппермен X . Физиология обмена веществ и эндокринной системы: пер. с англ._М., 1989 г .
15. Уитман Э. Thyroid International , 1 2005
16. Хилмэн Л.С., Хаддад Дж.Дж.// Нарушения обмена кальция. Под ред. Д.Хита, С.Дж. Маркса: пер. с англ. М. 1985 с 292-327
17. Чеботарев В.Ф. Эндокринная регуляция иммуногенеза К. 1979 г .
18. Чиппенс Г.И.// Иммунофизиология Под ред. Е.А. Корневой СПб 1993 с 632-656
19. Шхинек Э.К.// Иммунофизиология Под ред. Е.А. Корневой СПб 1993 с 389-400
20. Ярилин А.А. Основы иммунологии М. 1999 г .
21. Alonso N, Granada ML, Salinas I, Lucas AM, Reverter JL, Junca J, Oriol A, Sanmarti A. The Jurnal of Clinical Endocrinology & Metabolism 2005 Vol. 90, No.9 5254-5258
22. Barrett SP, van Driel IR, Tan SS, Alderuccio F, Toh BH, Gleeson PA. Eur J Immunol. 1995 Sep; 25(9): 2696-94
23. D`Elios MM, Bergman MP, Azzurri A, Amedei A, Benagiano M, De Pont JJ, Cianchi F, Vandenbroucke-Grauls CM, Romagnani S, Appelmelk BJ, Del Prete G. Gastroenterology. 2001 Feb; 120(2): 377-86
24. Fild J, Biondo NA, Murphy K, Alderuccio F, Toh BH. Int Rev Immunol. 2005 Jan-Apr; 24(1-2): 93-110
25. Junca J, Flores A, Granada ML, Jimenez O, Sancho JM. Br J Haematol. 2000 Nov; 111(2): 513-6
26. Kifor O, McEbduff A, LeBoff MS, Moore FD, Butters R, Gao P, Cantor TL, Kifor I, Brown EM. The Jurnal of Clinical Endocrinology & Metabolism 2004 Vol. 89, No.2 548-556
27. Li Y, Song Y-H, Rais N, Connor E, Schatz D, Muir A, Maclaren N. J. Clin. Invest. 1996 Feb; Vol. 97, No.4 910-14
28. Nishio A, Hosono M, Watanabe Y, Sakai M, Okuma M, Masuda T. Gastroenterology.1994 Nov; 107(5): 1408-14
29. Segni M, Borrelli O, Pucarelli I, Fave GD, Pasquino AM, Annibale B. The Jurnal of Clinical Endocrinology & Metabolism 2004 Vol. 89, No.10 4944-4948
30. Suri-Payer E, Kehn PJ, Cheever AW, Shevach EM. J Immunol. 1996 Aug 15; 1157(4): 1799-805
31. Toh BH, van Driel IR, Gleeson PA. N Engl J Med 1997 Nov 13; Vol. 337, No.20: 1441-1448
