Дмитрий Марфунин
"О язвенной болезни"
1. Как известно, желудочная кислота продуцируется париетальными клетками желудочных желез кислотопродуцирующей слизистой тела (корпуса) желудка [11]. Париетальные клетки экспрессируют различные рецепторы: Н2(гистамин), М3 (ацетилхолин), ССК2(гастрин) и sst2(соматостатин) [9]. Желудочная кислотная секреция, соотвественно, стимулируется гистамином, гастрином, ацетилхолином и ингибируется соматостатином. Гистамин продуцируется и секретируется паракринной секрецией энтерохромаффиноподобными (ECL) клетками, расположенными с внешней стороны париетальных клеток без контакта с просветом желудка [9,16]. Гастрин продуцируется и секретируется G-клетками, расположенными в антральной слизистой желудка [11,13]. Соматостатин продуцируется и секретируется паракринным путем D-клетками, расположенными как в антральной, так и в кислотопродуцирующей слизистой. Соматостатин является паракринным ингибитором, D-клетки находятся в тесном контакте с G и ECL-клетками. Антральный соматостатин действует на антральные G-клетки, в то время как соматостатин кислотопродуцирующей слизистой действует как на ECL-клетки, так и на париетальные клетки [11]. Холецистокинин (CCK) секретируется I клетками тонкой кишки [13] и индуцирует выпуск соматостатина из D-клеток, действуя на ССК1 рецепторы как в антральной, так и в кислотопродуцирующей слизистой, этим самым ингибируя гастрин-гистамин путь стимуляции секреции [9].
Кислотная секреция регулируется также нейротрансмиттерами, продуцируемыми внутренними нейронами myenteric ганглия, иннервирующего D, G, ECL и париетальные клетки. Внутренние нейроны содержат ацетилхолин, гипофизарный аденилатциклазу активирующий пептид (PACAP), VIP, галанин, гастрин выпускающий пептид (GRP) [9, 11]. VIP индуцирует выпуск соматостатина из D-клеток, но стимулирует выпуск гистамина из ECL-клеток, вероятно, через PACAP рецептор. PACAP – сильный стимул выпуска гистамина из ECL-клеток через рецептор PACAP-1. Ацетилхолин имеет прямой стимулирующий эффект на кислотную секрецию, действуя на М3 рецептор париетальных клеток [11]. В антральной слизистой D-клетки находятся под ингибиторным влиянием холинергических нервов, но стимулируются VIP и гистамином [16]. На основании вышеизложенных фактов регуляцию желудочной секреции можно представить в виде следующей схемы:
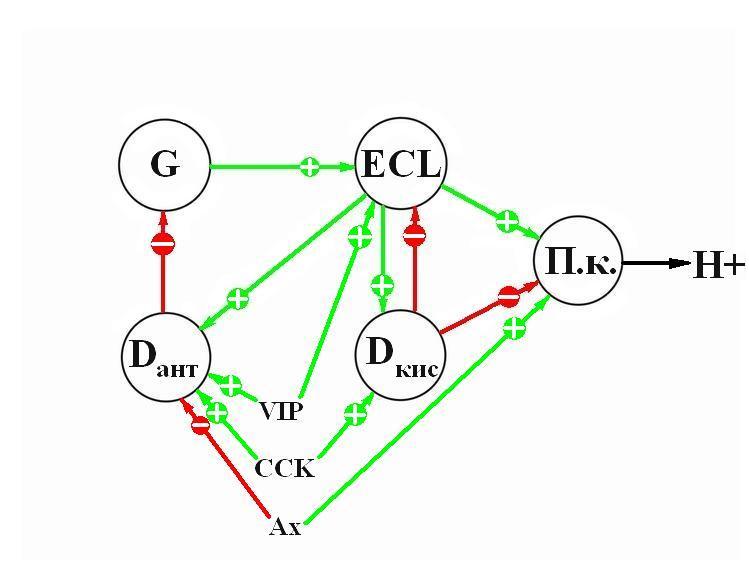
Можно отметить, что регуляция желудочной секреции осуществляется на трех уровнях: паракринными гормонами, циркулирующими гормонами и нейрогормонами. Отмечено также, что гистамин может влиять на желудочную секрецию косвенно, регулируя функцию G-клеток [10]. Инициация желудочной секреции через ваго-вагусные рефлексы независима от гастрина и ECL-клеток. В мышах гастрин-ССК двойного нокаута, несмотря на отсутствие гастрина и ССК, париетальные клетки нормально функционировали и были способны продуцировать желудочную кислоту в ответ на вагусное стимулирование и инъекцию гистамина, но не гастрина. Высказано предположение, что кислотный выход может быть определен балансом между стимулирующими сигналами гастрин-гистамин пути и ингибирующими сигналами ССК-соматостатин пути [9]. Вагусное же стимулирование независимо от этих путей, хотя предполагается существование ингибиторных Н3 рецепторов на вагусных терминалах [10].
Отмечено, что у пациентов, получавших длительное время кислотные ингибиторы, отмечается гипергастринемия, гиперплазия ECL-клеток и увеличение уровня гистамина [11]. Отмечается также, что повышенная кислотность в антруме ингибирует выделение гастрина.
Известно, что гастрин-подобный пептид обнаружен в мозге [13], также как и кальцитонин, но этот кальцитонин не поступает в общую циркуляцию [1]. Известно также, что экспрессия ССК2 рецепторов обнаружена в С клетках щитовидной железы [13] и гастрин стимулирует продукцию и секрецию кальцитонина С клетками (см. «О кальциевом гомеостазе»). Кальцитонин, в свою очередь, снижает уровень кальция в крови.
У больных язвенной болезнью (ЯБ) отмечаются конституциональные особенности – наклонность к вегетативным нарушениям, раздражительная слабость, плохая переносимость сильных раздражителей. На этом фоне длительные психоэмоциональные перегрузки, повторные психические травмы могут привести к развитию ЯБ [2]. Отмечаются также «стрессовые язвы», которые возникают у больных, находящихся в состоянии острого стресса [4]. Можно предположить, что нервная ткань, находясь в состоянии острого или длительного хронического стресса, нуждается в повышенном количестве кальция. Не имея возможности непосредственно влиять на продукцию кальцитонина, нервная ткань воздействует на уровень кислотности в полости желудка, повышая ее и тем самым снижая уровень гастрина в циркуляции. Снижение уровня гастрина снижает продукцию кальцитонина С клетками и способствует увеличению уровня кальция в крови. Значение уровня кальция подтверждается нахождением у части больных ЯБ аденоматоза паращитовидных желез, что сопровождается повышением уровня паратгормона в крови и увеличением уровня кальция [4]. Это вполне объяснимо, так как стрессовые катехоламины стимулируют продукцию паратгормона, который, повышая уровень кальция в крови, с другой стороны подавляет продукцию кальцитонина. При синдроме Золингера-Эллисона при гастриноме у 90% больных развивается ЯБ с гипергастринемеией и гипокальциемией и у 90% отмечается гиперплазия паращитовидных желез [4].
2. Как известно, желудки у более половины населения Земли колонизированы Helicobacter pylori (Н.р.). Единственная известная ниша Н.р. – слизистая желудка человека, в основном антрального его отдела [17]. Считается, что Н.р. – это составная часть микробиоценоза человека. В зависимости от обстоятельств Н.р. может вести себя как комменсал или даже симбионт, но иногда выступает в качестве патогена [3]. Н.р. положительные субъекты по большей части не подозревают об этом присутствии из-за недостатка симптомов. Н.р. нейтрофил с оптимальным ph 5,5 – 8.0, но одна из поразительных характеристик Н.р. – он способен заселять кислую инородную среду, хотя не является ацидофильным [17]. До 10% общего белка Н.р. составляет уреаза [17], но Н.р. с нефункциональной уреазой не в состоянии заселять слизистую при гипохлоргидрии – уреаза существенна для выживания независимо от своей роли в нейтрализации желудочной кислоты [19]. При перемещении Н.р. не используют градиент мочевины или бикарбоната, как можно было бы ожидать, а используют градиент ph, при нарушении которого Н.р. теряют пространственную ориентацию [17].
Вышеизложенные факты позволяют думать о том, что, во-первых, желудочная среда является враждебной для Н.р., о чем говорит область колонизации – антральный отдел с наименьшей кислотностью желудочного содержимого, а также большое количество уреазы в составе бактерии, необходимой для выживания в таких условиях, в том числе и с помощью нейтрализации кислотности. Во-вторых, несмотря на это, у Н.р. прослеживается определенная зависимость в поведении от уровня ph. В-третьих, в определенных случаях Н.р. начинает колонизировать остальную часть слизистой желудка с более агрессивной средой и, более того, ведет себя по отношению к слизистой агрессивно. Такое парадоксальное поведение Н.р. может быть объяснено лишь каким-либо внешним побудительным сигналом.
3. Известно, что иммунный надзор желудочного просвета мощный и бактериальное выживание требует его нарушения [7]. Колонизация Н.р. всегда ведет к инфильтрации в слизистую антрума и корпуса нейтрофилов и моноцитов [17], присутствуют также лимфоциты (Т и В), макрофаги, тучные клетки, дендритные клетки [6]. Желудочная слизистая обычно не содержит лимфоидной ткани, но со слизистой ассоциированная лимфоидная ткань (MALT) появляется почти всегда в ответ на колонизацию Н.р. [17]. Различные типы клеток, включая В клетки и CD4+ клетки, иногда организовываются в лимфоидные фолликулы [6].
Отмечено, что адаптивный иммунный ответ необходим для развития хронического желудочного воспаления в ответ на Н.р. Но в то же время желудочное воспаление не требуется для того, чтобы Н.р. постоянно заселял желудок [6]. Опосредованный ответ на инфекцию Н.р. не полностью защитный, так как инфекция может персистировать всю жизнь [20]. Воспалительный ответ, характеризованный инфильтрацией нейтрофилов, мононуклеаров и Т-хелперов (Th1), обычно нацелен на клиренс внутриклеточной инфекции. Однако Н.р. не является внутриклеточным патогеном, поэтому иммунный ответ редко кончается (если вообще кончается) клиренсом инфекции. Несмотря на то, что Н.р. не является внутриклеточным патогеном, адаптивный иммунный Th1 ответ начат и поддержан моноцитами и Th1 лимфоцитами, а не эпителиальными клетками. Считается, что большинство патологии, связанной с инфекцией Н.р., является результатом активности иммунной системы хозяина, а не от прямой бактериальной активности Н.р. Так, например, передача спленоцитов от Н.р. инфицированных мышей индуцирует гастрит [17]. Предполагают, что Т-регулирующие клетки в бессимптомных индивидуумах держат патологию более мягкой, чтобы избежать симптомов [20]. Ответы антител на факторы патогенности Н.р. остаются относительно постоянными более 20 лет наблюдения в индивидуальном хозяине, что подразумевает полную стабильность во взаимоотношениях [7]. Складывается впечатление, что в диалоге Н.р. с иммунной системой хозяина ведущая роль принадлежит иммунной системе и она имеет цель отнюдь не уничтожение инфекции.
4. Показано, что Н.р., инфицирующие антрум, связаны с гиперфункцией G-клеток [13]. Н.р. вызывают уменьшение уровня соматостатина и гипергастринемию. Гастрин считается специфическим фактором роста для Н.р. [7,16]. Хотя фаза острого Н.р. гастрита часто связана с гиперхлоргидрией [4,17], но при хроническом пангастрите Н.р. подавляют кислотное производство как косвенно, ингибируя продукцию гистамина ECL-клетками, так и непосредственно, ингибируя функцию париетальных клеток [7], с развитием гипохлоргидрии [16,17]. Сокращенная кислотная секреция далее увеличивает уровень гастрина [7]. Эрадикация же Н.р. ведет к увеличению кислотной секреции [17]. В мышах, сверхэкспрессирующих ген гастрина, гипергастринемия связана с повышенной кислотной секрецией и увеличением париетальных клеток. Однако после этого начального ответа наблюдается уменьшение числа париетальных клеток и развитие гипохлоргидрии. Это состояние подобно атрофическому гастриту у людей и обнаружено совместно с Н.р. [13].
Вышеизложенное позволяет думать о том, что инфекция Н.р. в любом случае ведет к повышению уровня гастрина: при инфицировании антрума – путем стимуляции G-клеток, при пангастрите – подавлением кислотной секреции.
5. Н.р. является особенно крайним примером с высоким показателем мутации и так же высокой частотой рекомбинации [7]. Изоляты, полученные от различных индивидуумов, показывают существенное генетическое разнообразие [14]. По сути, каждый Н.р. положительный субъект несет отличный штамм [17]. Анализ показал как отсутствие последовательностей, так и присутствие дополнительных ДНК относительно основного штамма. Считается, что генетические изменения развились в течение колонизации единственного хозяина. Н.р. очень компетентные для получения ДНК от других штаммов Н.р. [7]. Н.р. имеют возможность терять и приобретать внешнюю ДНК [14], которая обычно имеет аберрантное CpG содержание и часто несет гены, включенные в вирулентность [17]. В геноме Н.р. обнаружено обильное количество систем рестрикции и модификации (restriction and modification) (R-M). Каждая R-M система включает эндонуклеазу, которая расщепляет специфическую последовательность ДНК, и ДНК-метилтрансферазу, которая метилирует аденозин или цитозин в пределах той же последовательности ДНК. В некоторых случаях показано, что они могут быть получены из клеток хозяина [21].
В геноме некоторых Н.р. присутствует так называемый cag островок патогенности (cag-PAI). Бактерии Н.р. могут привести к накоплению генных мутаций и эпигенетических изменений в эпителиальных клетках независимо от основного воспаления [22]. Продукты cag-PAI играют роль в изменении трансформации гена в желудочных эпителиальных клетках [6]. Один из генов cag-PAI, cagA, кодирует фактор вирулентности CagA, который, проникая в клетку хозяина, приводит к ее морфологическим изменениям. Другой фактор вирулентности, VacA, являясь продуктом vacA гена cag-PAI, формирует в мембранах эпителиальных клеток поры, индуцируя выпуск мочевины и анионов из клеток хозяина [17], а также индуцирует ослабление эпителиальных плотных соединений [7]. Факторы вирулентности обладают также проапоптическим эффектом, который ограничен париетальными клетками и ведет к сокращению кислотной секреции [17]. Никакие гомологи не известны для cagA в других видах Н. или в других бактериях. Предполагают, что он отражает специфический ген человеческого желудка. Также никакие близкие гомологи VacA не существуют в других видах Н. и других бактериях, что предполагает его значение для специфических отношений Н.р. с человеческим желудком [7].
В геноме Н.р. cag-PAI кодирует также белки, формирующие аппарат IV типа системы белковой секреции (pT4SS) в виде шприцеподобной структуры, способной проникать в желудочные эпителиальные клетки и облегчающей транслокацию CagA, VacA, пептидогликанов и других факторов в клетки хозяина [17,23]. Введение же ДНК связано с типом IV системы секреции для соединения (cT4SS), которая кодируется comB cluster и обозначается как comB system [23]. Так как Н.р. могут легко терять или приобретать экзогенную ДНК, cag-PAI, возможно, был приобретен от другого огранизма горизонтальной передачей, так как содержание CpG отличается от этого в остальном геноме [14,19].
Вышеизложенное позволяет думать о том, что в определенный момент «мирные» Н.р. приобретают экзогенную ДНК, встраивающуюся в геном и позволяющую бактерии не только продуцировать факторы вирулентности, но и формировать уникальную структуру для введения в клетки хозяина как факторов вирулентности, так и ДНК.
6. При хроническом гастрите отмечается увеличение частоты гиперметилирования CpG островков генов DAP-киназы (связанного с апоптозом) и Е-кадгерина (связанного с плотным соединением эпителиальных клеток) [15]. Н.р. был независимым фактором риска, связанным с метилированием Е-кадгерина гена в неповрежденной желудочной слизистой [8]. Среди инфицированных Н.р. субъектов 53,6% показали Е-кадгерин метилирование в желудке [18]. Частота метилирования была более высокой в антруме [8,18]. После эрадикации Н.р. было значительное уменьшение плотности метилирования промотора Е-кадгерина гена [18] или оно вообще исчезало [8]. Метилирование СОХ-2 промотора регулирует экспрессию СОХ-2 эпителиальными клетками в ответ на Н.р. – неметилированный промотор СОХ-2 увеличивал экспрессию СОХ-2 и наоборот [5]. Высказано предположение, что маловероятно, чтобы сами Н.р. являлись фактором, непосредственно вызывающим изменение в метилировании эпителиальной ДНК, так как, подвергая желудочные клеточные линии сокультивированию с Н.р., не обнаружили никакого эффекта на статусе метилирования СОХ-2 промотора [5] и никакого увеличения метилирования островков CpG Е-кадгерина гена [18]. У желудков, инфицированных Н.р., увеличена активность N-метилтрансферазы [10]. Отмечено, что ДНК Н.р. очень метилирована в отличие от в основном неметилированной ДНК большинства бактерий [7]. Гастриты с выраженной инфильтрацией мононуклеарными клетками показали более высокое число метилированых генов, чем с умеренной инфильтрацией [15]. Предполагают, что Н.р. может быть возможным двигателем изменений метилирования [18].
Можно думать о том, что присутствие Н.р. необходимо для изменения статуса метилирования тех или иных генов, но сам процесс метилирования индуцируется не Н.р., а, очевидно, мононуклеарными клетками.
7. Н.р. экспрессируют липопротеиды (LPS), которые являются слабыми активаторами иммунного ответа, они в 1000 раз менее эффективны, чем LPS E.coli и быстрое созревание дендритных клеток в ответ на интактные Н.р. независимо от LPS Н.р. [20]. Но они структурно имитируют антигены Lewis группы крови, обнаруженные на человеческих клетках [6,17]. Они также могут имитировать антигены других групп крови [17]. Кроме этого, Н+/К+ ATPase (протонные насосы) париетальных клеток также имеют Lewis эпитоп и могут быть целью для иммунной системы в хроническом гастрите [19]. Как предполагают, это может индуцировать продукцию аутоантител против протонных насосов [17]. Некоторые Т-клеточные клоны от Н.р. инфицированных пациентов признают эпитопы протонных насосов на париетальных клетках [6]. Как известно, протонные насосы находятся на апикальном полюсе париетальной клетки и в норме не могут быть достижимы для иммунных клеток. Представляется возможным участие Н.р. в осуществлении воздействия иммунной системы на протонные насосы париетальных клеток. Но для этого необходим побудительный мотив, направленный на подавление кислотной секреции (протонные насосы, как известно, секретируют Н+ ионы).
8. В дополнение к интимному нахождению на поверхности эпителиальной клетки, Н.р. может захватывать интерклеточное пространство и присутствовать в пределах некоторых эпителиальных клеток, париетальных клеток и иммуноцитов [12]. Экспрессия Lewis антигена повышает бактериальную интернализацию эпителиальными клетками [17]. Н.р., содержащие cag-PAI, были быстрее интернализованы в актин-богатые фагосомы. Фагоцитированные Н.р. оставались жизнеспособными, подвижными и ультраструктурно неповрежденными в течение инкубирования с полиморфноядерными лейкоцитами и моноцитами. Слияние гомологичных фагосом вело к образованию мегасом, содержащих многочисленных Н.р., которые были жизнеспособны в течение 24 часов. Вход в клетки, не способные к фагоцитозу, включал другой механизм с прилипанием Н.р. к псевдоподиям, возникающим из клетки, и прогрессивным поглощением Н.р. зиппер-подобным способом. In vivo, как предполагают, интернализованные Н.р. могут вновь репопулировать внеклеточную среду. Предполагают, что интернализация Н.р. используется для медленного деления и временного укрытия от неблагоприятных условий. Высказано также предположение, что, так как доля внутриклеточных Н.р. против внутриполостных будет ~1%, то инвазивные бактерии клинически не важны. Но бактерии, расположенные в цитоплазме, имеют потенциал модифицировать множество цитоплазматических и ядерных процессов и могут вызвать CpG метилирование и мутации ДНК особенно потому, что гены вирулентности экспрессируются в эпителиальных клетках. Хотя отмечается, что никакой фактор Н.р. не будет основой для вторжения и внутриклеточного выживания [12].
Вышеизложенное позволяет думать о том, что, во-первых, если допускается, что возможно влияние интернализованых Н.р. на внутриклеточные процессы эпителиальных и других клеток, то можно также допустить, что поглотившие Н.р. клетки могут влиять на процессы, происходящие внутри бактерий. Во-вторых, интернализация Н.р. имеет некоторое сходство с интернализацией лимфоцитов эпителиальными клетками тимуса (так называемыми «клетками–няньками»). Как считают, в тимусе в течение этого процесса происходит созревание и дифференцировка лимфоцитов. По аналогии можно предположить, что в слизистой желудка интернализация Н.р., в частности, иммунными клетками, может использоваться для специфической дифференцировки Н.р. с приданием им агрессивных патогенных свойств.
Таким образом, на основании вышеизложенных фактов и умозаключений и принимая во внимание, что лимфоидная ткань также чувствительна к изменению концентрации кальция в крови, как и нервная ткань, можно предположить, что Н.р., эволюционируя с человеком в течение, как предполагают, десятков тысяч лет, стал использоваться лимфоидной тканью человека как инструмент для поддержания кальциевого баланса в организме. При нарушении этого баланса (со стороны нервной ткани) лимфоидная ткань может инициировать соответствующее воздействие Н.р. на слизистую желудка: вначале стимуляцией G-клеток, затем пангастритом с воздействием на кислотную секрецию. При неэффективности (при продолжающемся повышенном влиянии нервной ткани) воздействие Н.р. может усугубиться с развитием атрофического гастрита или даже образованием эпителиального дефекта (собственно язвы). С этой точки зрения можно объяснить как сезонность обострений ЯБ (как известно, активность нервной ткани испытывает сезонные изменения), так и случаи спонтанного выздоровления (восстановление баланса).
Итак, язвенную болезнь можно рассматривать как конфликт между нервной и лимфоидной тканью, а слизистую желудка – как зону морфологических проявлений этого конфликта.
ЛИТЕРАТУРА:
1. Држевецкий Ю.М.// Советская медицина 1988 г ._№8_с 28-32
2. Циммерман Я.С.// Клиническая медицина 1993 г ._№1_с 6-11
3. Циммерман Я.С.// Клиническая медицина 2006 г ._№3_с 9-19
4. Ресурс Интернета
5. Akhtar M, Cheng Y, Magno RM, Ashktorab H, Smoot DT, Meltzer SJ, Wilson KT. Cancer Research 2001, March 15, 61, 2399-2403
6. Algool HMS, Cover TL. Clin Microbiol Rev. 2006 Oct; 19(4): 597-613
7. Blaser MJ, Atherton JC. J Clin Invest. 2004 Feb 1; 113(3): 321-333
8. Chan AOO, Peng JZ, Lam SK, Lai KC, Yuen MF, Cheung HKL, Kwong YL, Rashid A, Chan CK, Wong BC-Y. Gut 2006; 55: 463-468
9. Chen D, Aihara T, Zhao C-M, Hakanson R, Okabe S. Am J Physiol Gastrointest Liver Physiol 2006. 291: G539-G544
10. Coruzzi G, Morini G, Adami M, Grand D. Journal of Physiology and Pharmacology 2001, 52, 4, 539-553
11. Cui G, Waldum HL. World J Gastroenterol 2007 Jan 28; 13(4): 493-496
12. Dubois A, Boren T. Cell Microbiol. 2007 May; 9(5): 1108-1116
13. Dubresne M, Seva C, Fourmy D. Physiol Rev. 2006. 86: 805-847
14. Israel DA, Salama N, Krishna U, Rieger UM, Atherton JC, Falcow S, Peek RM Jr. PNAS 2001. Dec. 4, vol 98 no. 25, 14625-14630
15. Kang GH, Lee HJ, Hwang KS, Lee S, Kim J-H, Kim J-S. American Journal of Pathology. 2003; 163: 1551-1556
16. Konturek SJ, Konturek PC, Brzozowski T, Konturek JW, Pawlik WW. Journal of Physiology and Pharmacology 2005, 56, 4, 507-530
17. Kusters JG, Vliet van AHM, Kuipers EJ. Clinical Microbiology Reviews. 2006, July, Vol. 19, No3, p 449-490
18. Leung WK, Man EPS, Yu J, Go MYY, To K, Yamaoka Y, Cheng VYY, Ng EKW, Sung JJY. Clinical Cancer Research 2006, May 15, Vol 12, 3216-3221
19. Olivares D, Gisbert JP. Rev Esp Enferm Dig (Madrid) 2006, Vol 98, No 5, p 374-386
20. Szczepanik M. Journal of Physiology and Pharmacology 2006, 57, Supp 3, 15-27
21. Vale FF, Vitor JMB. Applied and Environmental Microbiology, 2007, July, Vol 73, No 13, p 4243-4249
22. Yao Y, Tao H, Park DI, Sepulveda JL, Sepulveda AR. Helicobacter. 2006 Aug; 11 (4): 272-86
23. Zhong Q, Shao S, Cui L, Mu R, Ju X, Dong S. Chinese Medical Journal 2007, Vol 120 No 23: 2138-2142

